La importancia de la citología como ayuda en el diagnóstico, se puede leer en el siguiente párrafo. Ghisleni,G. Vet. Clinical. Path. Vol 35/ No.1/ 2006.
“ En la medicina veterinaria el examen microscópico de muestras citológicas son incuestionablemente de una gran ayuda diagnóstica. Es una técnica que se puede utilizar en una gran variedad de tejidos (órganos) y líquidos, siendo una herramienta rápida, mas económica , no es quirúrgica, etc. Teniendo siempre en cuenta que el objetivo es llegar a un diagnóstico preliminar, el cual dependiendo del conocimiento y experiencia del interprete puede ser definitivo”.
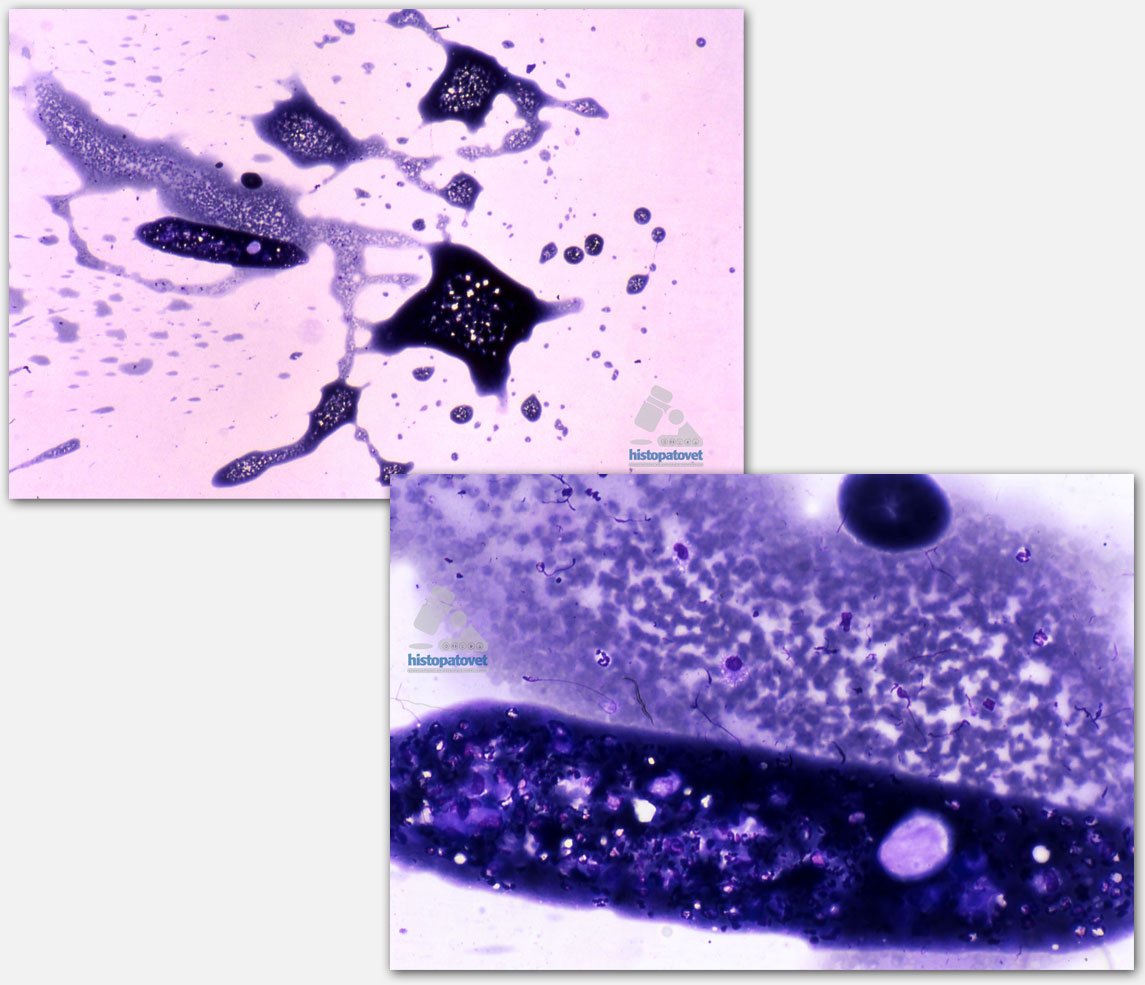
Recordemos que la citología es una técnica diagnóstica complementaria en relación con la histopatología. en términos de lograr un diagnóstico e informe final la citología comparada con la histopatología, es menos invasiva, más rápida, etc. Por el contrario, la histopatología tiene en la mayoría de los casos un mayor valor diagnóstico, ya que permite evaluar con mayor detalle la arquitectura del órgano o tejido y su relación con su contorno o medio celular. Sin embargo, especialmente en algunos tumores, la citología puede ser muy determinante. Ver el siguiente ejemplo de una tumor venéreo transmisible cutáneo. En este paciente se remitió la biopsia( no bien preservada) y una citología de la misma masa, en donde la citología fue más determinante para el diagnóstico final.
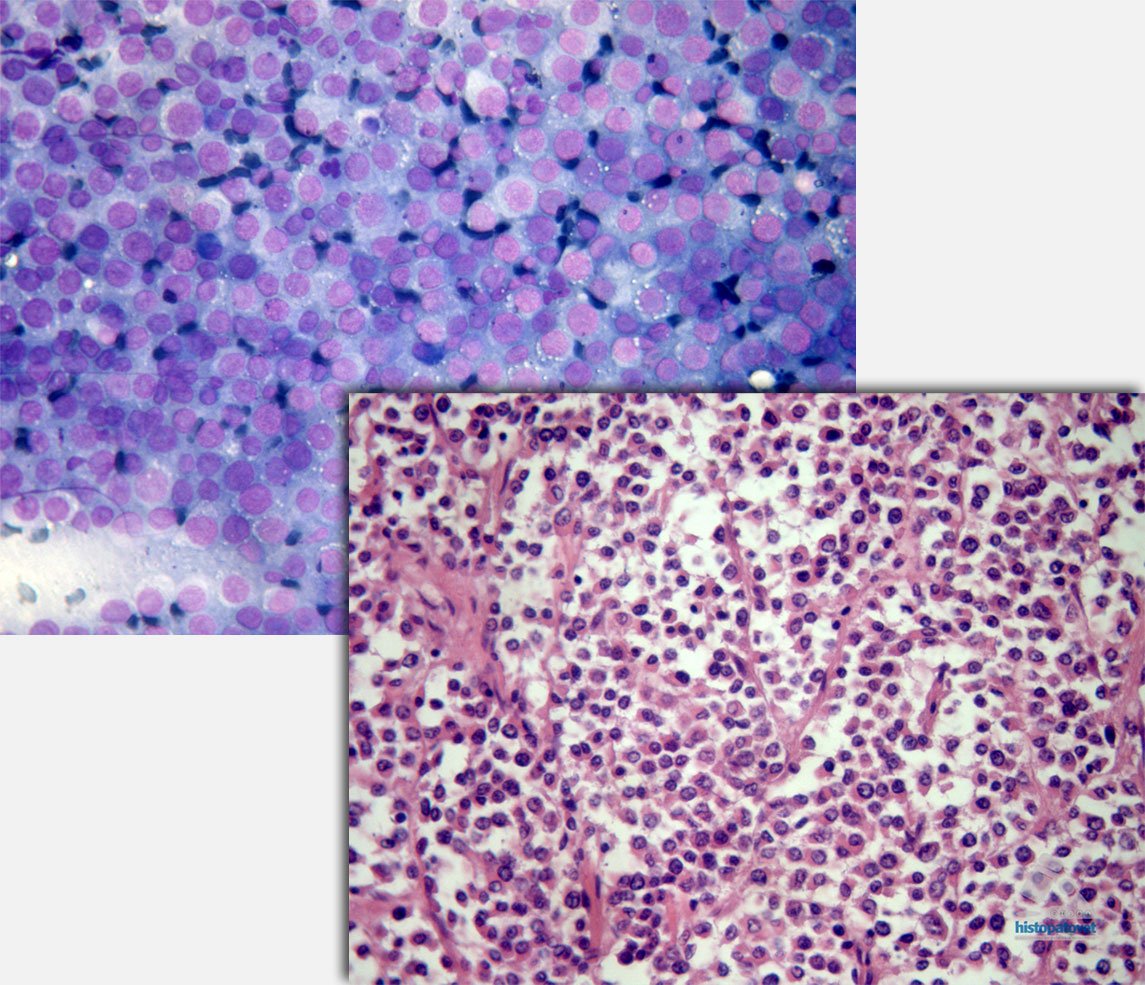
Fig.1. En la izquierda superior, la imagen citológica. Abajo la histopatología. Ambas fotos fueron tomadas con el mismo aumento.
ALGUNOS EJEMPLOS EN DONDE SE PUEDE UTILIZAR LA CITOLOGÍA.
-EFUSIONES: Tórax, abdomen, etc.
-SEDIMENTOS URINARIOS:( lavados, etc.)
-MUCOSAS: Conjuntiva, Rectal etc.
-ÓRGANOS O MASAS EN CAVIDADES INTERNAS: Próstata, Bazo, Hígado etc.
-LINFOADENOPATÍAS.
-LESIONES CUTÁNEAS O SUBCUTÁNEAS: Úlceras, Nódulos, Fístulas, etc.
-LAVADOS O ASPIRADOS: Respiratorios, gástricos etc.
-EVALUACIÓN DE MASAS O LESIONES ENCONTRADAS DURANTE UNA CIRUGÍA.
-OTRAS.
En la actualidad el uso de la citología, especialmente a nivel dérmico (piel) son de un gran valor, sobretodo en lesiones nodulares o no nodulares, fistulizadas, etc. Ver la siguiente figura de una lesión nodular fistuliz

Fig. 2. Imagen superior cuello ventral. Cortesía Dr. Walter Salas. Abajo. Piodermia pio-granulomatosa.
EXISTEN DOS MÉTODOS O TÉCNICAS PARA COLECTAR O TOMAR LA MUESTRA(BIOPSIA).
A- La biopsia por aspiración con aguja delgada o fina.
- Se realiza con una jeringa y una aguja; siendo muy importante la selección de ambas.
- Dependiendo de la consistencia del tejido o masa; la jeringa puede variar de 3 a 20 ml o cc, incluso se pueden utilizar hipodérmicas, en caso de nodulitos o pústulas.
- Por ejemplo en masas suaves como los linfonodos, se puede usar jeringas de 3.0 ml.
- Cuando la masa es dura como fibromas, carcinomas(desmoplasia), etc., se requieren jeringas más grandes para hacer mejor la succión.
- El diámetro de la aguja varía de 20 a 25.
- En masas muy duras se puede usar hasta una 16.
- En general, entre más suave( consistencia) tenga el tejido más pequeña es la jeringa y más delgada la aguja (menos diámetro).
- Generalmente cuando las agujas son de mucho calibre, por ejemplo menores de 22 se aspiran pedacitos de tejido y no células libres. También en estos casos, se puede aspirar mucha sangre (contaminación).
Preparación del lugar a aspirar:
- Como regla si la zona a aspirar tiene muchos pelos, se debe depilar.
- En caso de muestras( citologías) de cavidades, tipo peritoneo, tórax, articulaciones o cuando hay que remitir muestra a microbiología, el área debe ser preparada asépticamente tipo quirúrgica( cirugía).
- Caso contrario, su preparación es parecida a cuando se vacuna o se toma una muestra para hematología o química sanguínea (algodón, alcohol).
- Si se va a tomar guiada por ultrasonido, es mejor no usar el gel, sustituyéndolo por alcohol como agente de contacto.
- La razón es que aunque sea poco el gel que se queda en la aguja; y al momento de expulsar el material al portaobjetos y luego hacer la tinción, el gel se tiñe de rosado, creando problemas para la interpretación celular.
La técnica por aspiración.
- Es una buena técnica para masas especialmente cuando son muy vascularizadas o con líquidos.
- También cuando se obtienen dirigidas por ultrasonido.
- También funciona en masas o tumores de consistencia suave.
- Procedimiento:
- Es importante que el paciente esté bien sujeto.
- Con una mano se sujeta la masa, con la otra la jeringa ya con la aguja montada, la cual se introduce en el centro de la masa.
- Luego se aspira de forma fuerte creando una presión negativa, llevando el embolo a la mitad del barril o ¾ de la jeringa.
- Se mantiene la presión negativa, moviendo la jeringa con la aguja varias veces( arriba-abajo)dentro de la masa sin sacar la aguja.
- Luego se introduce el embolo eliminando la presión negativa y se saca la jeringa con la aguja.
- Luego expulse o tire el material al portaobjeto( al centro o al extremo). Ver próxima figura.

Fig.4. Ejemplo de una masa sólida. A- Se introduce la aguja dentro de la masa llevando el embolo hacia abajo. B- Luego se hace la presión negativa, llevando el embolo a unos ¾. Dentro de la masa, se mueve la jeringa/aguja varias veces. C- luego se elimina la presión negativa y se saca la jeringa/aguja, depositando el material en el portaobjeto.
Es conveniente tomar la jeringa lo más craneal posible (cerca de la aguja) y con la otra mano sostener muy bien la masa a aspirar. Ver los dos siguientes figuras.
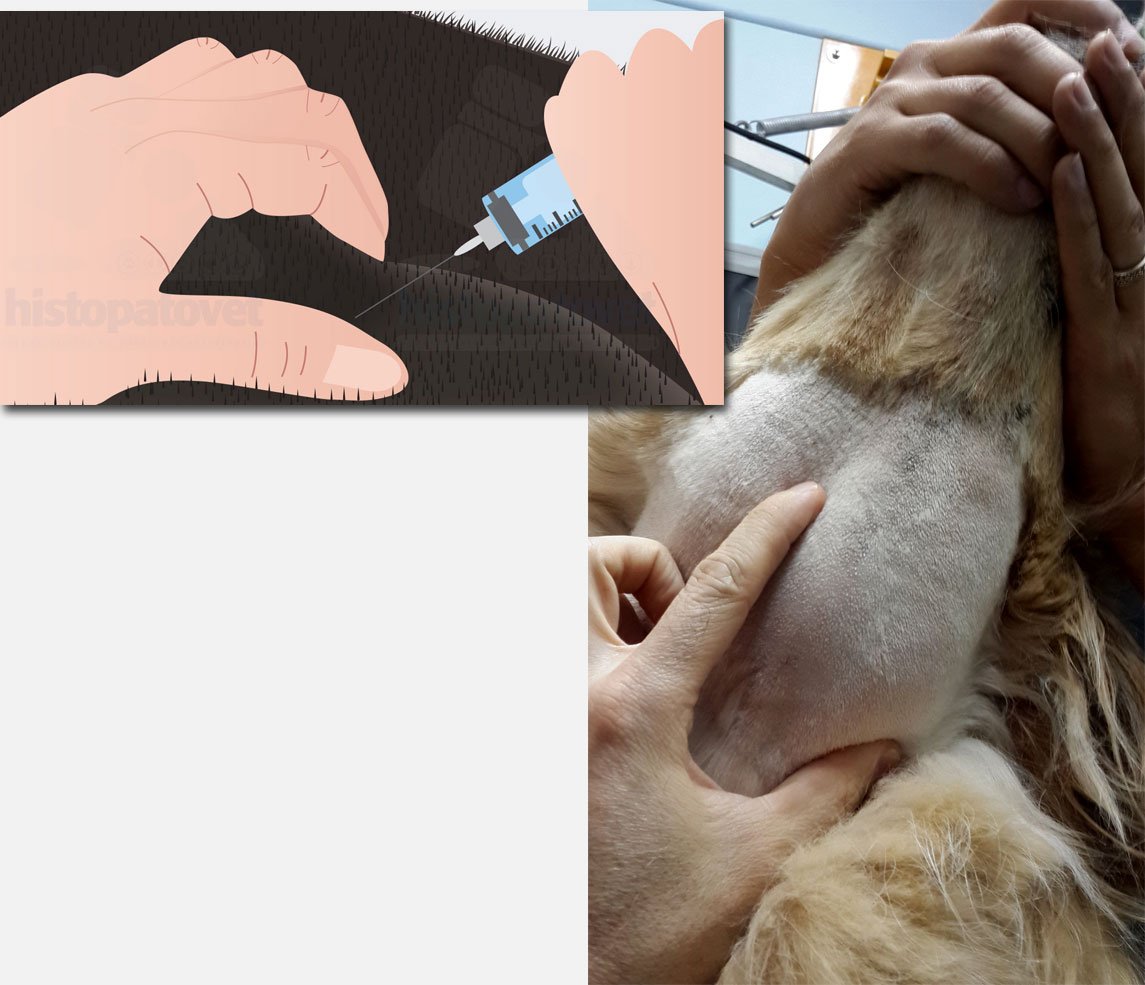
Fig.5. A la izquierda la ilustración de cómo sujetar e introducir la jeringa con la aguja. A la derecha la forma correcta de sujetar la masa al aspirar.
Resumen por aspiración.
- Se introduce la aguja en la masa.
- Inmediatamente, se hace presión negativa aspirando y llevando el embolo hasta la mitad del cilindro.
- La aguja se mueve dentro de la masa (sin sacarla), varias veces en diferentes direcciones, manteniendo la presión negativa.
- Luego se introduce el embolo eliminando la presión, y se saca la jeringa.
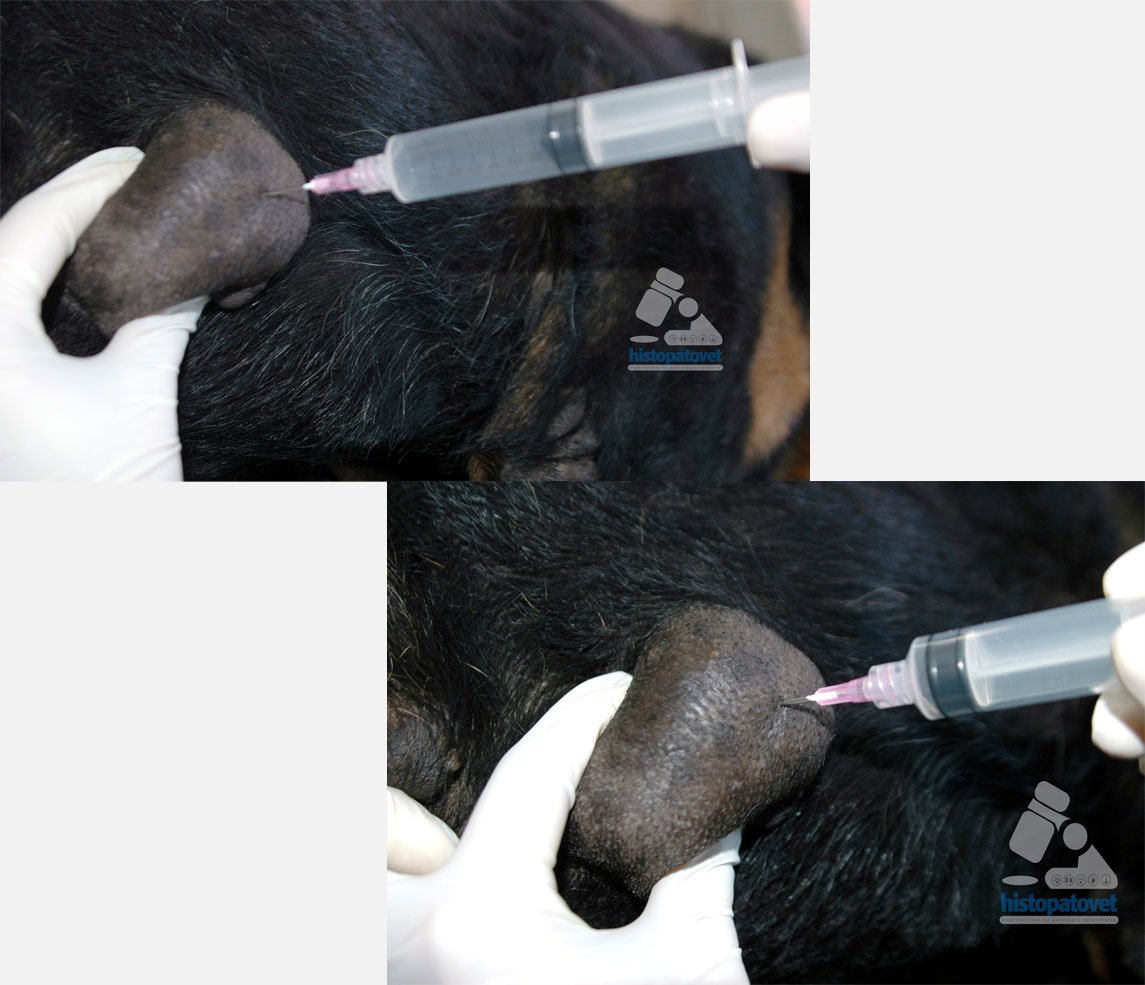
Fig.6. A la izquierda el embolo está a la mitad del cilindro. A la derecha ya la presión se ha eliminado. Ahora hay que sacar la aguja con la jeringa y expulsar el material al portaobjeto.
B- Técnica sin aspiración o por capilaridad.
- Es una técnica muy parecida a la descrita por aspiración, con la excepción de que no se utiliza la presión negativa durante la colecta o toma de la muestra.
- Se usa una jeringa y aguja parecida a la técnica por aspiración(agua de 22 a 25. Jeringa de 3 a 20 ml).
- Comentario: al no haber aire en la jeringa el procedimiento es más rápido, evitando que la muestra se seque.
- Hay que introducir la aguja sin sacarla unas 8 a 10 veces de forma rápida. Ver Siguiente ilustración.
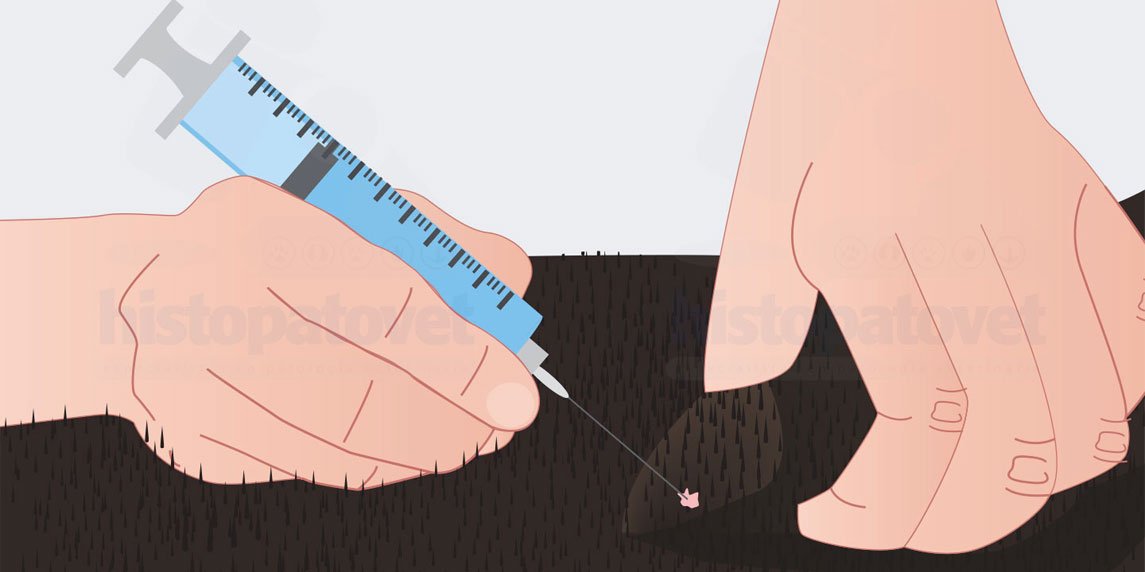
Fig.7. El embolo está a unos ¾. Con una mano sostiene la masa. Igual a la con aspiración la aguja se introduce varias veces.
- Recordatorio general: En caso de masas especialmente sólidas, es recomendable tomar varias muestras( de 4 a 5), cambiando de jeringa, ya que el diagnóstico final es un resumen del análisis de todas las muestras remitidas.
- Recuerde: Cuando se envía una sola muestra y esta resulta no ser diagnóstica. Las razones para este no diagnóstico pueden ser varias( ejemplos):
1- Que la masa era muy dura y no se logró aspirar (aguja no correcta).
2- Que hubo contaminación sanguínea (Ver causas más adelante).
3- Algo muy frecuente es que la aguja no fue introducida en la masa, ver siguiente ilustración.

Fig.8. A la izquierda la aguja está afuera de la masa (no diagnóstica). A la derecha está en el lugar correcto.
Los linfonodos generalmente están rodeados por una cápsula externa de grasa, a veces sólo se aspira esta grasa, es decir la aguja no está dentro del sitio correcto. Ver siguiente figura
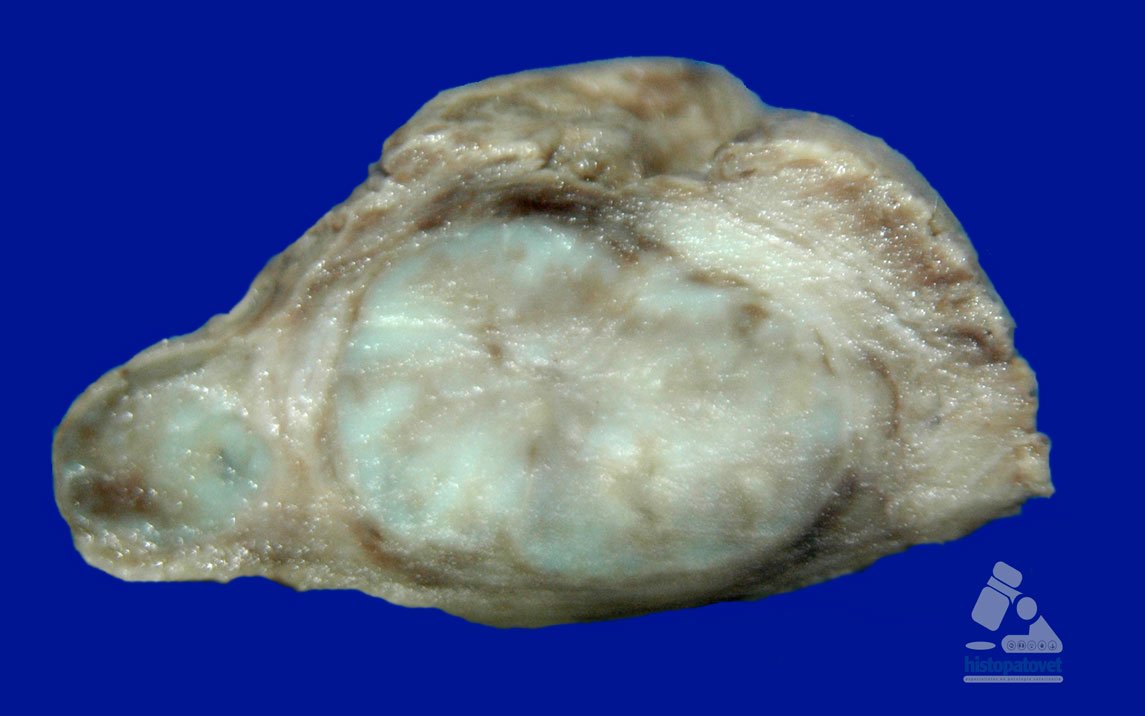
Fig.9. Corte transversal. En el centro un linfonodo hiperplásico, rodeado por una cápsula. Luego una gruesa capa de grasa (más dorsalmente). Nota: en el extremo izquierdo hay un linfonodo satélite.
- Nota: no es posible saber cual es la mejor muestra (lámina), sin antes teñirla y estudiarla. En otras palabras todas las láminas remitidas se deben colorear y analizar, para luego poder hacer un resumen de todas ellas (diagnóstico final).
Algunos consejos generales sobre la toma:
- Haga o prepare la mayor cantidad de muestras posible y envíelas todas (como regla de 4 a 5).
- Si son varias masas a muestrear, enumérelas indicando en la historia clínica la sede anatómica.
- Siempre use jeringas y agujas nuevas.
- De ser posible use portaobjetos con un borde esmerilado.
- Evite la contaminación con sangre.
- Las dos principales causas de la contaminación con sangre son:
1-Usar una aguja delgada (mayor de 21)
2-Prolongar el tiempo de aspiración “concepto holandés rápido pero bien”.
- No sea tímido (a). Sucede cuando la presión negativa es inadecuada.
- NOTA: Como regla general, los líquidos, especialmente el cefalorraquídeo o de cavidades preformadas, como la peritoneal, son muy críticos en relación con el tiempo que transcurre entre la toma y el montaje de la muestra. Aún en refrigeración se contaminan.
- Por lo anterior lo recomendable, es centrifugarlo de forma inmediata y montar la muestra del sedimento (material en el fondo del tubo).
- De lo contrario se debe coordinar con algún laboratorio cercano para que lo realicen y monte(prepare) las muestras inmediatamente.
- La segunda opción sería refrigerar, pero aún así, hay cambios celulares y contaminación bacteriana (saprofitos),sobre todo si se deja para el próximo día.

Fig.10. A derecha un líquido torácico (quilotorax). A la izquierda liquido de una masa (glándula mamaria). Observe que en ambos casos, sin haberse centrifugado ya se aprecia un poco de sedimento (fondo del tubo).
PREPARACIÓN DE LA MUESTRA (MONTAJE EN EL PORTAOBJETO).
I-Aspirado de muestras o tejidos sólidos.
A-Técnica portaobjeto sobre portaobjeto (un portaobjeto horizontal).
En general, si se hace bien, es el mejor método. Ver siguiente figura.
B-Deposición y extensión del material recolectado con la técnica de aplastamiento.
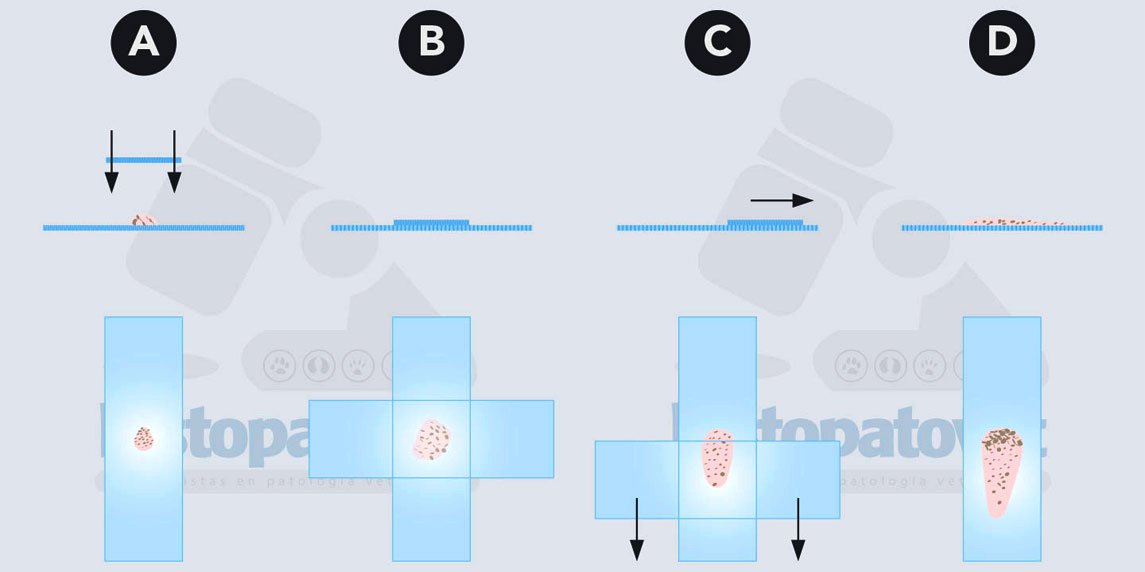
Fig.12. El material se pone en el centro del portaobjetos y luego se extiende. Se puede hacer con la técnica anterior o con la del frotis sanguíneo( ver el siguiente ejemplo).
C-Deposición y extensión del material recolectado con la técnica del frotis sanguíneo.
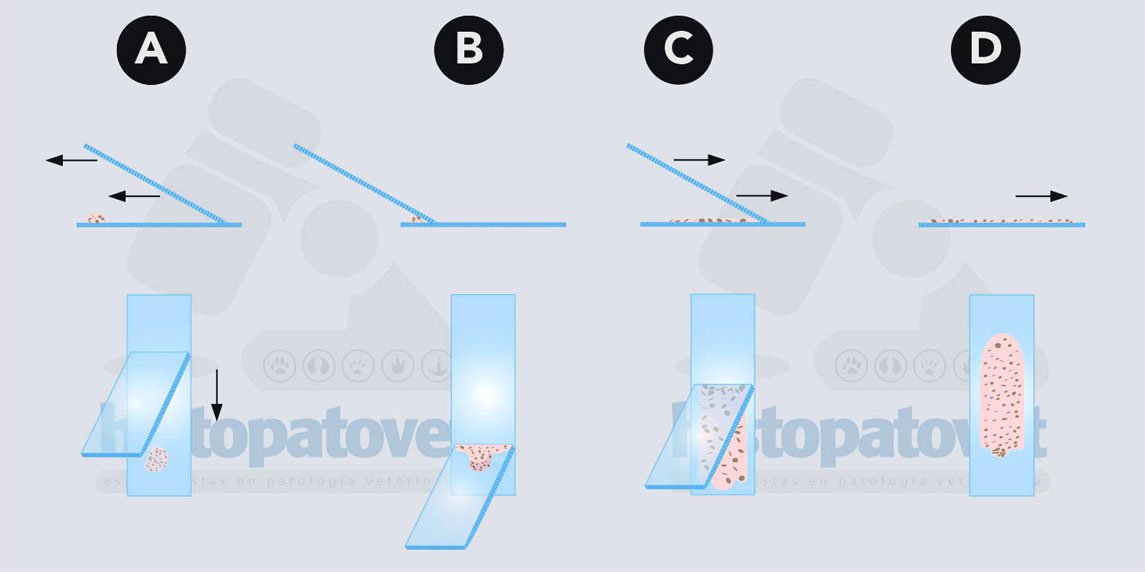
Fig.13. Técnica del frotis sanguíneo. Es la mejor cuando el material es un poco líquido. Vea que idealmente el material se pone en el extremo del portaobjeto.
D-Técnica tipo “estrella de mar”- “starfish”.
Es una técnica que casi no daña las células frágiles, pero el preparado queda muy grueso.

Fig.14. con esta técnica, el material se pone en el centro y se extiende con la punta de la jeringa.
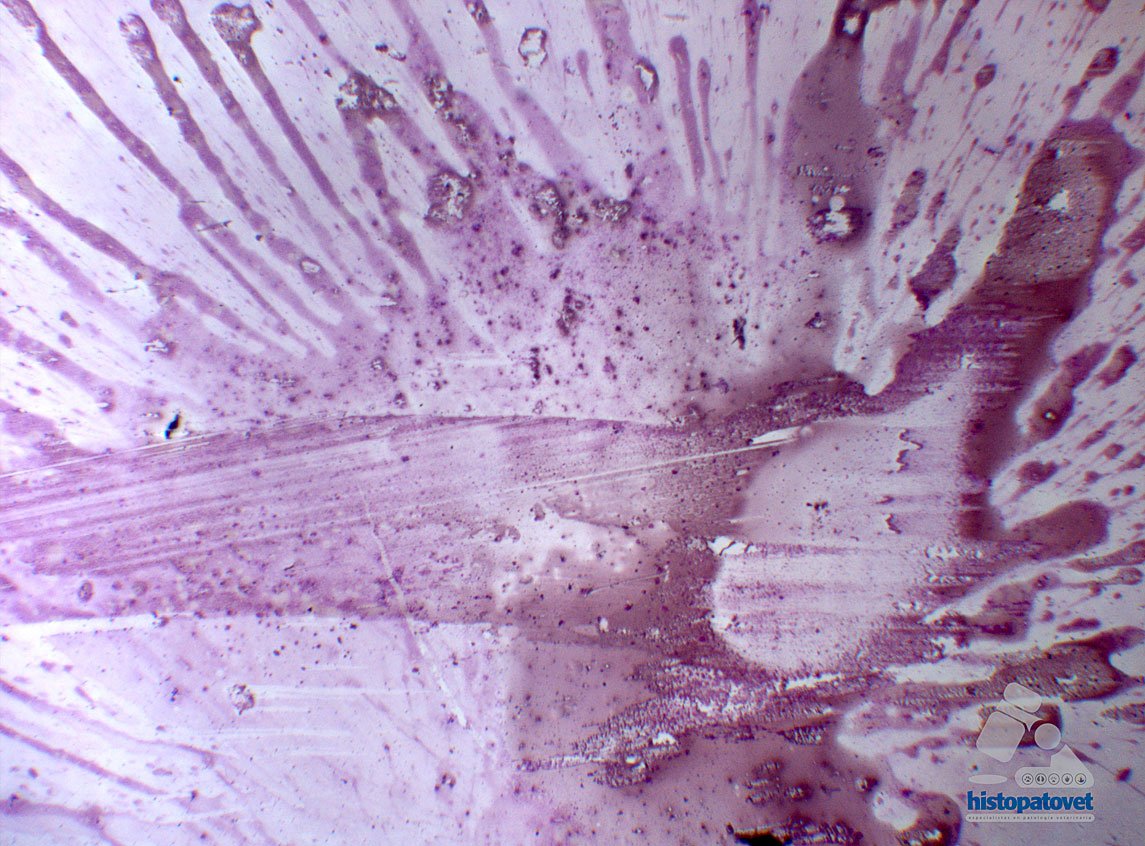
Fig.15. Técnica de estrella de mar. Observe que queda una capa gruesa de células y a su vez son muy dispersas.
Algunos consejos en la preparación de la muestra.
1-No permita que la muestra se seque o coagule, antes de montarla.
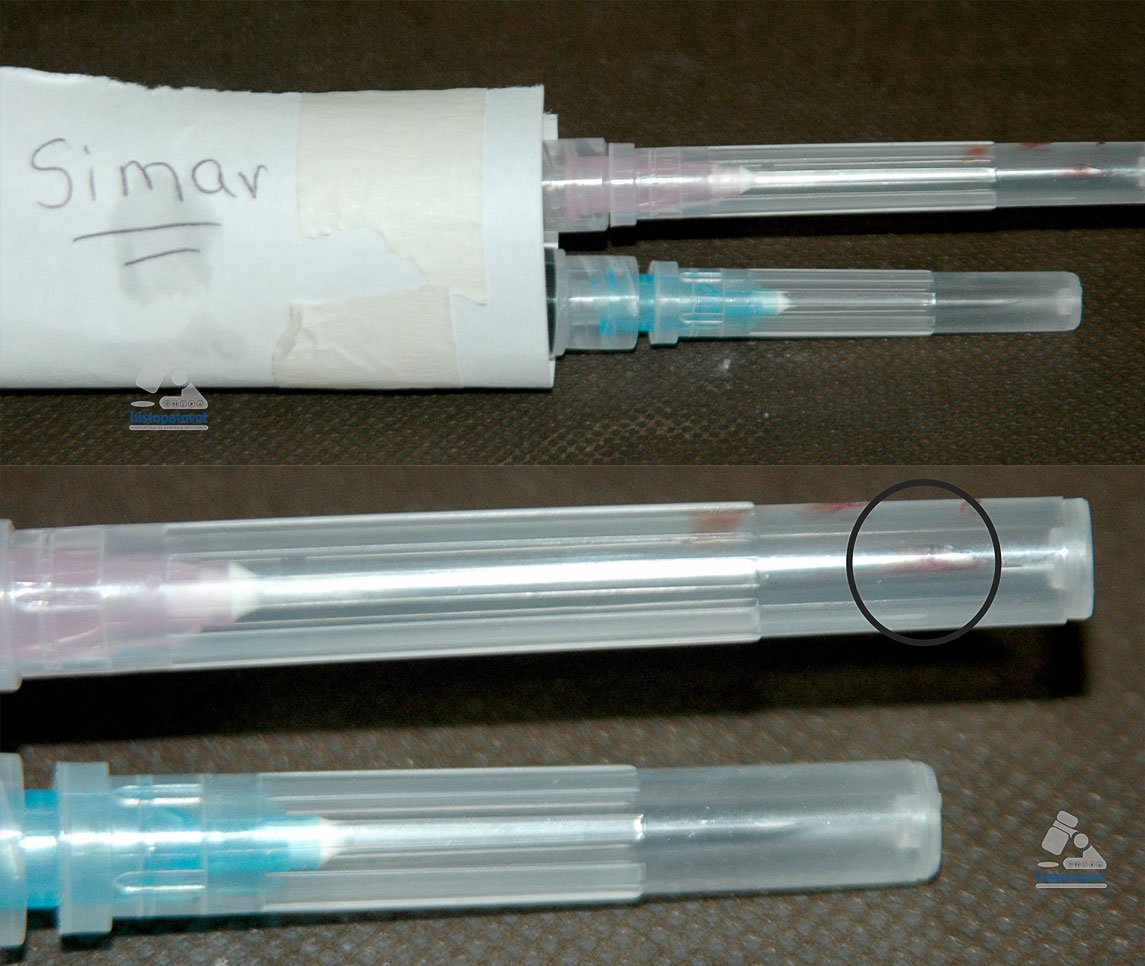
Fig.16. No se debe enviar el contenido en la jeringa, como en este caso, ya que el material se seca. En otras palabras lo debe montar de forma inmediata.
2-No “tire” la muestra en el preparado a mucha distancia (“múltiples gotas”).
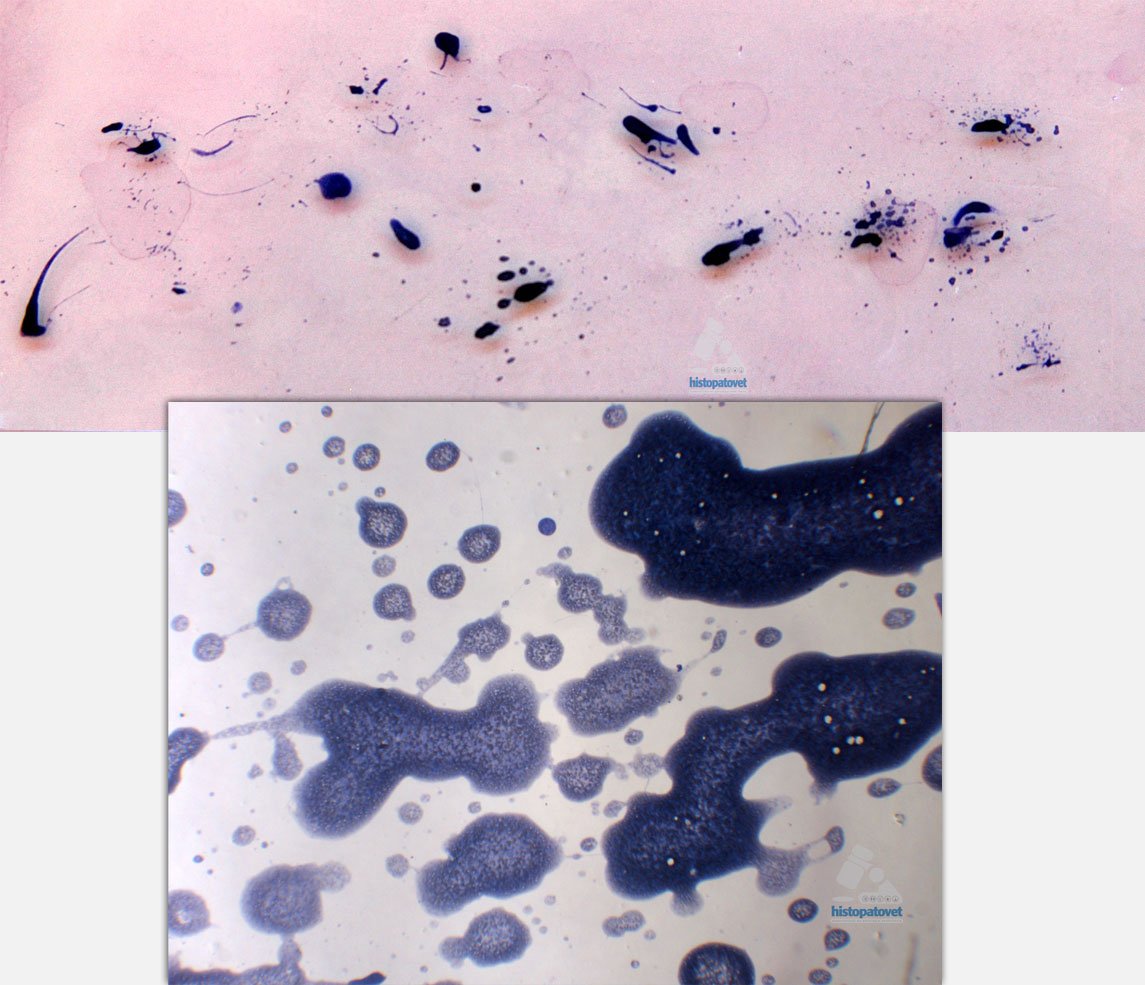
Fig.17. Material salpicado. Debido a esto el material queda disperso en todo el portaobjeto y no en un sólo lugar como es ideal.
3-Evite el hacer o montar un preparado muy grueso.
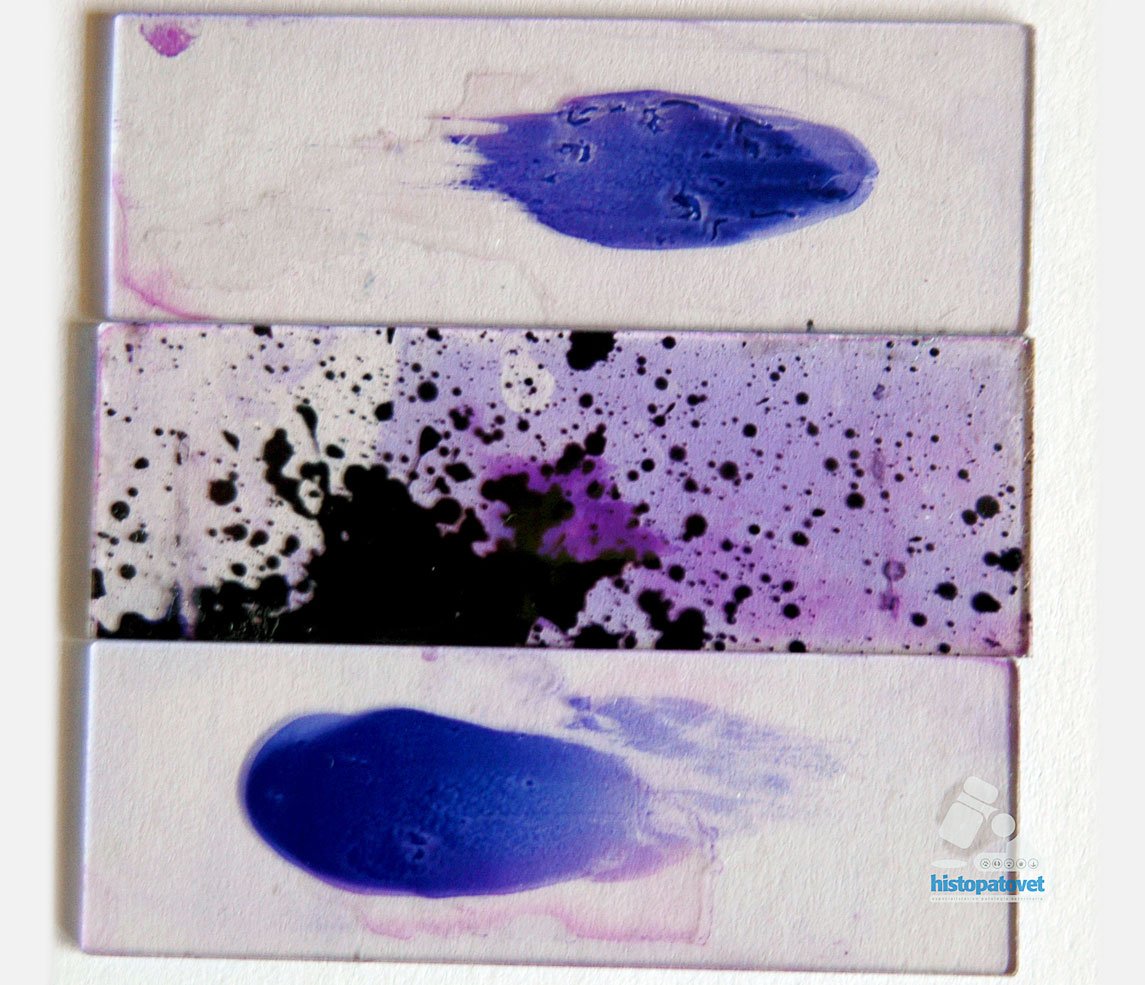
Fig.19. Comparación entre la forma correcta (portaobjeto superior e inferior). La lámina del medio es incorrecta.
4- Muy importante no ejerza mucha presión al momento de hacer el extendido en el porta objetos ya que provoca ruptura de las células. Ver siguiente figura.
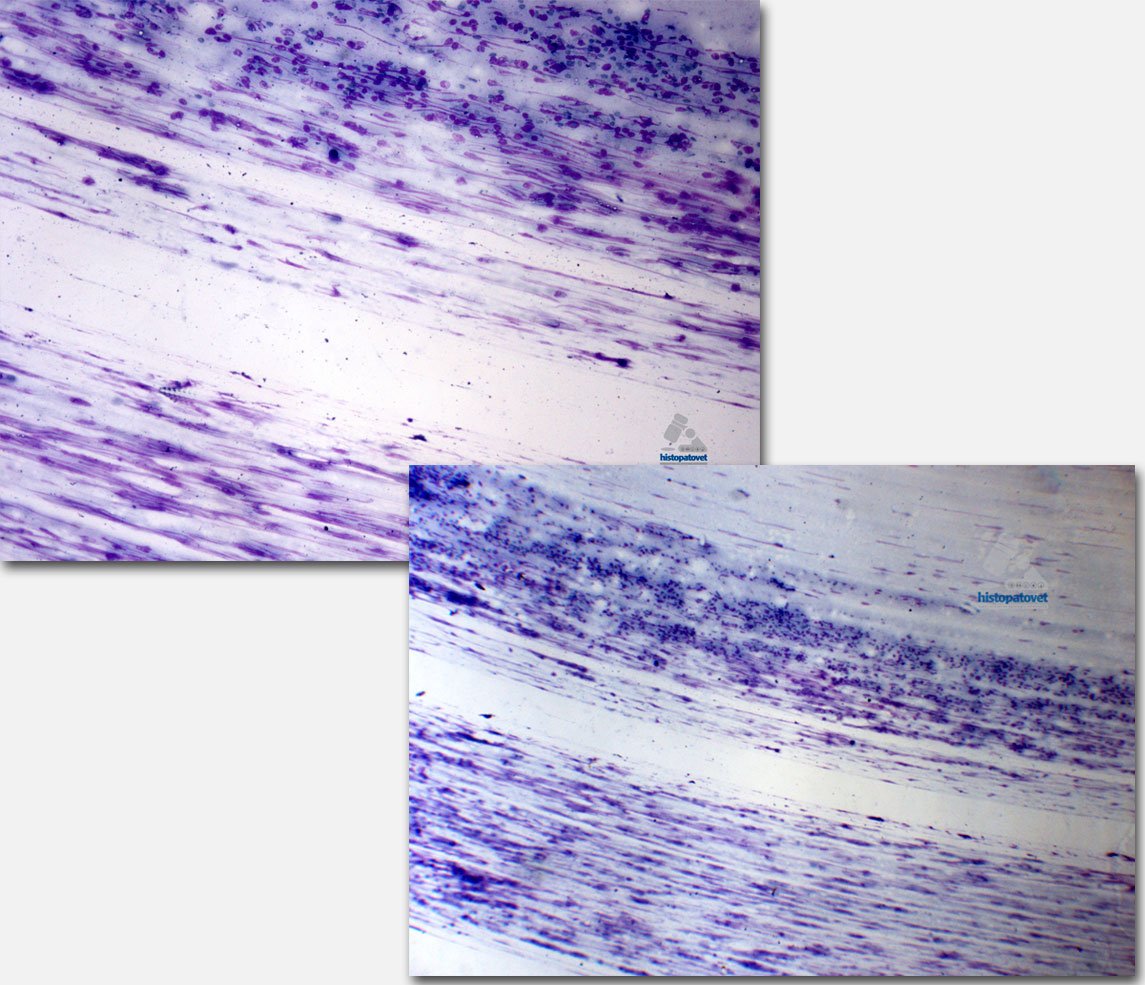
Fig.20. Observe especialmente en la parte inferior, que debido a la presión, las células se rompieron quedando solo restos de ellas (filamentos).
II-Preparación o montaje de muestras líquidas, como centesis de cavidades, lavados, o lesiones quísticas
1-Se recomienda ponerlo en EDTA para evitar la coagulación, especialmente, si lo debe enviar (no montado) en la jeringa al laboratorio.
Comentario. También sin EDTA (Berrocal, A. experiencia personal) funciona bien.
2-Por ser una técnica que seca al aire, no es necesario fijarlas o teñirlas antes de enviarlas.
3. HISTOPATOVET, utiliza la tinción de GIEMSA.
ALGUNOS IMPORTANTES ARTEFACTOS.
Nota: una mala muestra (toma, manejo, preservación, etc.) provoca un mal diagnóstico.
- Importantísimo. Los portaobjetos debe estar limpios y secos (la técnica es en seco).
- Se deben limpiar previamente con alcohol y secarlos; especialmente si ha estado guardado por mucho tiempo.
La muestra no se puede poner en la refrigeración u otro lugar donde se moje o humedezca

Fig. 21. A la izquierda un portaobjeto sucio. A la derecho, debido a la suciedad hay crecimiento de hongos saprofíticos.
MEDIO DE TRANSPORTE AL LABORATORIO ESPECIALIZADO.
Existen cajas especiales para el transporte, las cuales no solo prevén la suciedad, pero también muy importante evita en muchos casos, que los portaobjetos se quiebren (otra causa del no diagnóstico).
Las caras donde se hizo el extendido, nunca se debe tocar con otra superficie incluyendo los dedos.

Fig. 22. A la derecha, diferentes tipos de cajas de transporte. A la derecha un ejemplo de cómo no hay que enviar la muestra.
CONCLUSIÓN FINAL: Además del conocimiento y la experiencia del interprete (citopatólogo), el diagnóstico final depende en mucho de la calidad de la muestra, la cual tiene que ver con la toma y correcta preparación de la muestra, al igual que su adecuado manejo incluyendo el transporte.
En otras palabras es muy frustrante para el dueño, el veterinario(a) que el informe final diga “MUESTRA NO DIAGNÓSTICA”.
BIBLIOGRAFÍA RECOMENDADA:
– Raskin,R.E. and Meyer,D.J. Canine and Feline Cytology. A color atlas interpretation guide. Second edition, 2010.
– Valenciano, A.C. and Cowell,R.L. Cowel and Tyler´s. Diagnostic cytology and hematology of the dog and cat. Fourth Edition. 2014.